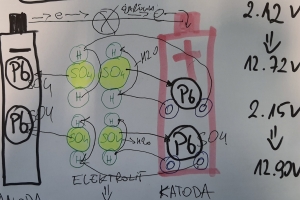
Kiedy dwa różne materiały elektrod (takie jak dodatnia i ujemna płyta akumulatora kwasowo-ołowiowego) są zanurzone w roztworze elektrolitu (takim jak kwas siarkowy i woda), powstaje napięcie i poniekąd jest to moment powstania akumulator. Powstałe napięcie zależy od rodzaju materiałów zastosowanych w elektrodach i zastosowanego elektrolitu. Napięcie wynosi w przybliżeniu od 2,1 do 2,2 V na ogniwo w typowym akumulatorze kwasowo-ołowiowym i jest zależne od stężenia elektrolitu kwasu siarkowego.
Energia elektryczna jest wytwarzana w wyniku reakcji chemicznej między różnymi materiałami elektrod i elektrolitem. Kiedy rozpoczyna się reakcja chemiczna, energia elektryczna wypływa z akumulatora, gdy tylko zamkniemy obwód między dodatnim i ujemnym biegunem (pojawia się obciążenie). Prąd elektryczny przepływa jako elektrony przez obwód zewnętrzny i jako naładowane jony między płytami wewnątrz akumulatora.
Napięcie akumulatora kwasowo-ołowiowego zależy od materiałów użytych do jego budowy. Te chemikalia to:
- Dwutlenek ołowiu (PbO2) - materiał na kratce dodatniej.
- Ołów porowaty (Pb) - materiał na kratce ujemnej.
- Kwas siarkowy (H2SO4) - elektrolit.
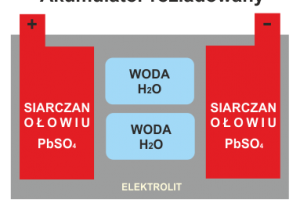
Rozładowanie - pobór energii z akumulatora
Gdy akumulator jest podłączony do zewnętrznego obciążenia, płynie prąd i akumulator zaczyna się rozładowywać. Dwutlenek ołowiu (PbO2) w płycie dodatniej jest związkiem ołowiu (Pb) i tlenu (O). Kwas siarkowy (H2SO4 w elektrolicie) jest związkiem kationów wodorowych (H +) i anionu siarczanowego (SO42-). Gdy akumulator rozładowuje się, dwutlenek ołowiu (PbO2) w materiale aktywnym płyty dodatniej łączy się z jonami wodoru (H +) i siarczanu (SO42—) z kwasu siarkowego, tworząc siarczan ołowiu (PbSO4) i wodę (H2O) na powierzchni dodatniej płyty.
Jednocześnie podobna reakcja zachodzi na płycie ujemnej. Ołów (Pb) z ujemnego materiału aktywnego łączy się z jonami siarczanowymi (SO42—) z kwasu siarkowego, tworząc siarczan ołowiu (PbSO4) w płycie ujemnej.
W miarę postępu rozładowania ciężar właściwy elektrolitu jest zmniejszany przez zużycie kwasu siarkowego w wyniku reakcji. Ciężar właściwy można zmierzyć za pomocą areometru, który zapewnia oszacowanie rozładowania akumulatora. Alternatywnie można to również oszacować poprzez pomiar napięcia otwartego obwodu (OCV) akumulatora po odłączeniu obciążenia ale dopiero po ustabilizowaniu się akumulatora (OCV).
Podczas rozładowania aktywny materiał obu elektrod przekształca się w nieprzewodzący siarczan ołowiu (PbSO4), a stężenie kwasu słabnie. W konsekwencji napięcie spada, ponieważ zależy od potencjału między dwoma materiałami płyty (ujemnej Pb i dodatniej PbO2), Spada wewnętrzne przewodnictwo akumulatora ( konduktancja ). Ostatecznie akumulator nie może już dostarczać energii elektrycznej o użytecznym napięciu i mówi się, że jest rozładowany.
Wpływ zimy.
Gdy akumulator jest narażony na wysokie tempo rozładowania (np. rozruch zimnego silnika)w niskich temperaturach np. (-18 ° C), w dodatku przez dłuższy czas, znacząco szybciej się rozładowuje. Wynika to z faktu, że dyfuzja kwasu do porów płyt i dyfuzja wody z porów płyt jest zbyt wolna, aby utrzymać wyładowanie.
Dyfuzja to samorzutne przenikanie cząsteczek jednej substancji do drugiej, prowadzące do wyrównania stężenia. Zjawisko dyfuzji obserwujemy bardzo często, na co dzień. Przykładem jest rozprzestrzenianie się zapachów w powietrzu, parzenie herbaty, a nawet oddychanie.
Bardzo mały procent elektrolitu i materiałów czynnych na płytach w ogniwach akumulatora może zostać wykorzystany podczas stosunkowo krótkiego czasu trwania wyładowania o dużej szybkości. Tylko materiał na lub w pobliżu powierzchni płyt bierze udział w reakcji chemicznej z powodu ograniczeń przewodnictwa jonowego. Z tego powodu akumulatory samochodowe muszą mieć duże powierzchnie płyt na każde ogniwo. Porowate materiały (czyli takie które mają małą gęstość) na płytach zatrzymują większe ilości elektrolitu, umożliwiając dłuższe utrzymywanie zimnych wyładowań.
Przy małych wartościach prądu rozładowania (lub inaczej mówiąc przy wolnym rozładowywaniu akumulatora) praktycznie cały kwas może zostać zużyty, a materiał w pobliżu środka wewnętrza płyt ma większą możliwość wziąć udziału w reakcji chemicznej.
Rozładowany akumulator można doładować (czyli przepuścić przez niego prąd elektryczny w kierunku przeciwnym do rozładowania), a jego aktywne materiały zostaną przywrócone do pierwotnego składu. Po całkowitym naładowaniu bateria jest ponownie gotowa do dostarczenia pełnej mocy. Ten cykl rozładowania i ładowania może być powtarzany w kółko, aż do chwili pogorszenie się kondycji płyt lub uszkodzenie akumulatora.
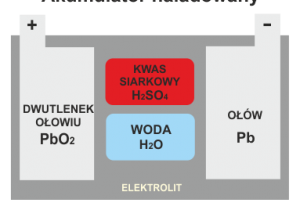
Cykl ładowania
Reakcje chemiczne zachodzące w akumulatorze podczas ładowania są w zasadzie odwrotnością tych, które zachodzą podczas rozładowywania. Siarczan (PbSO4) w obu płytach jest rozszczepiany na pierwotną formę ołowiu (Pb) i siarczanu (SO4). Woda jest rozszczepiana na wodór (H) i tlen (O). Siarczan w płytach łączy się z wodorem w wodzie i jest przywracany do kwasu siarkowego (H2SO4). W tym samym czasie tlen z wody łączy się chemicznie z ołowiem płyty dodatniej, tworząc dwutlenek ołowiu (PbO2). Ciężar właściwy elektrolitu wzrasta podczas ładowania, ponieważ tworzy się kwas siarkowy, który zastępuje wodę w elektrolicie.
Gazowanie
Po całkowitym naładowaniu akumulatora proces ładowania jest kontynuowany w tzw. Ładowaniu wyrównawczym. Podczas ładowania wyrównawczego akumulator będzie wydzielał gazy na płytach dodatnich i ujemnych. Gazowy wodór (H2) jest wytwarzany na płycie ujemnej, a gazowy tlen (O2) na płycie dodatniej. Gazy te powstają w wyniku rozkładu wody (H2O). Akumulator gazuje (wykorzystując wodę), ponieważ jest ładowany z wyższą szybkością, niż może przyjąć ładunki elektryczne. Może to wynikać z tego, że akumulator jest już w pełni naładowany lub jego płyty są zasiarczone ewentualnie jest zbyt zimny, aby przyjąć ładunek. Zasadniczo akumulator „gazuje” pod koniec ładowania. Ładowarka, która automatycznie zmniejsza szybkość ładowania, gdy akumulator zbliża się do stanu pełnego naładowania, eliminuje większość tego gazowania.
Niezwykle ważne jest, aby nie przeładowywać akumulatorów, w których nie możemy uzupełnić wody np. AGM i GEL z zaworami VRLA ponieważ spowoduje to rozkład wody, której w szczelnych akumulatorach nie można uzupełnić. Oczywiście żaden akumulator nie powinna być przeładowywana przez dłuższy czas, bo powoduje to degradację materiałów aktywnych.
Zaś zaleta krótkiego gazowania gazowania to możliwość uniknięcia stratyfikacji elektrolitu, czyli jego rozwarstwienia, czym zajmę się w kolejnym odcinku.
Jęli wolisz wersję wideo, zapraszam: https://www.youtube.com/watch?v=t8oq0V9SBn0
Podziel się: